지난 해 국내 의약품 임상시험의 글로벌 순위가 한 계단 상승해 5위를 기록했다.
식품의약품안전처(처장 오유경)와 국가임상시험지원재단(이사장 박인석)은 '2022년 의약품 임상시험 승인 현황'을 발표했다.
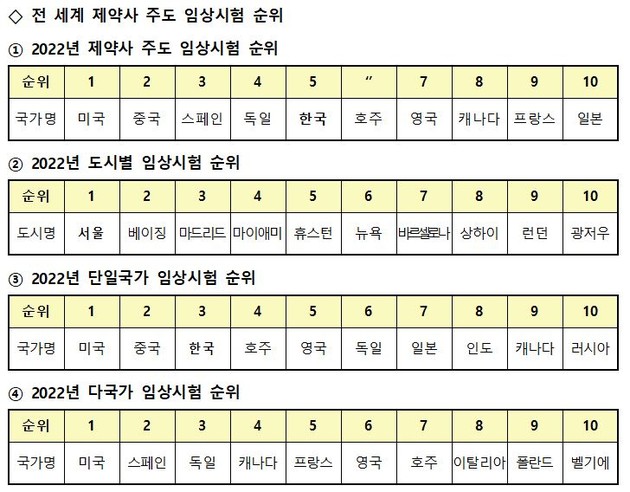
지난해 전 세계 임상시험 등록 건수에서 우리나라가 '국가별 점유율' 순위 5위를 기록, 역대 최고 순위를 갱신했고, 전 세계 '도시별 임상시험'에서 서울이 1위, '단일국가 임상시험'은 우리나라가 3위로 예년과 동일한 순위를 유지했다. '다국가 임상시험'은 유럽 국가의 점유율이 높아지며 우리나라는 전년 대비 한계단 하락한 11위를 기록했으나 아시아 국가 중에서는 여전히 가장 높은 순위를 기록했다.
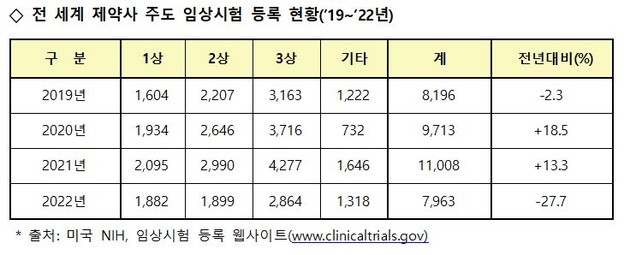
글로벌 경기침체에 따른 신약 개발 R&D 투자의 위축과 코로나19 관련 의약품의 임상시험 감소 등의 영향으로 '제약사 주도 전 세계 임상시험 등록 건수'가 전년 대비 대폭 감소(전년 대비 27.7%↓)했다.
2022년 국내 임상시험 현황 주요 특징은 △임상시험 승인 건수가 코로나19 유행 이전 수준으로 회귀 △제약사 주도 임상시험 비중 증가 △국내 제약사가 개발한 임상시험의약품을 사용한 임상시험 전년도 수준을 유지한 것으로 나타났다.
먼저 지난해 국내 임상시험 승인 건수는 전 세계 임상시험 감소 추이에 따라 전년 대비 15.6% 감소한 711건으로 코로나19 유행 이전(2019년)과 유사한 수준으로 회귀했다.
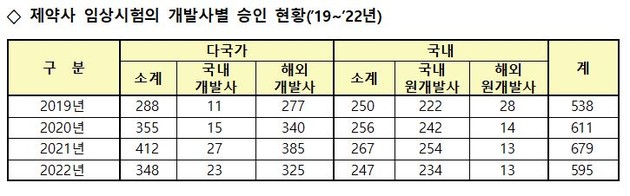
또 전체 임상시험 중 '제약사 주도 임상시험' 승인 건수는 595건으로, 전체 임상시험 승인 건수 중 83.7%를 차지하며 전년(80.6%) 대비 3.1%P 증가했다. '연구자 임상시험'은 승인 건수와 비중 모두 감소했다.
해외 제약사가 개발한 의약품을 사용한 임상시험은 전년 대비 15.1% 감소했으나, 국내 제약사가 개발한 의약품을 사용한 임상시험은 8.5% 감소했다.
※ ①∼④ 출처: 미국 NIH, 임상시험 등록 웹사이트(www.clinicaltrials.gov)
식약처는 국가임상시험지원재단과 함께 우리나라에서 진행되는 신약 개발 과정이 더욱 신속하고 안전하게 진행될 수 있도록 적극적으로 지원하고 있다.
국가임상시험지원재단은 국내 임상시험 인프라 강화와 차질없는 안전한 임상시험 수행을 위한 실질적 지원을 확대하고 국내 임상시험 역량에 대한 국제 경쟁력을 확보함으로써 글로벌 임상시험의 국내 유치를 유도하는 등 우리나라 임상시험의 국제 영향력 확대를 위해 노력할 계획이다.
식약처는 임상시험의약품에 대한 안전성 정보 관리 강화 등 임상시험 참여자의 안전과 권익 보호를 위해 지속적으로 제도를 개선하고, 비대면 임상시험, 신기술 의약품 개발 등 급속한 임상시험 환경 변화에 선제적으로 대응해 국내 임상시험이 국제 표준을 선도할 수 있도록 할 방침이다.
이원식 기자의 전체기사 보기
Copyright @보건신문 All rights reserved.