최근 미국 식약청(FDA)의 화장품 제조기업에 대한 검증이 강화되면서 한국 화장품·제약기업에 대한 경고장(Warning Letter) 발송 건수도 급격히 증가하고 있다. 미국 내 K뷰티의 인기와 함께 한국 등 아시아 국가로부터 화장품 수입이 증가하고 있는 점이 미국 식약청의 규제 강화로 이어졌다는 분석이다. 이에 따라 국내 관련 업계도 적극적인 대비책이 마련이 필요한 것으로 지적되고 있다.
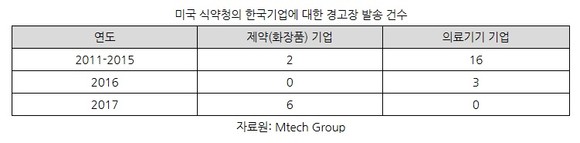
코트라(KOTRA) 임소현 미국 뉴욕무역관은 최근 통상·규제 보고서에서 이같이 밝히고 미국 FDA의 화장품 제조시설 검증 강화 추세에 대해 분석했다. 보고서에 따르면 한국 기업에 대한 미국 식약청의 경고장 발송 건수는 지난 2011~2016년 화장품·제약기업 2건, 의료기기 기업 19건이었으나 2017년 한 해에만 한국 화장품·제약기업에 6건이 발송된 것으로 조사됐다.
FDA는 2년마다 제조업체 현장 검증을 실시하는데, 현장검증 비용을 제조업체가 부담하지 않고 미국 식약청 예산으로 충당하고 있어 모든 업체를 검증하기보다 블랙리스트 기업이나 갑자기 미국 내 판매가 증가한 기업 등을 겨냥해 조사를 실시하는 경향이 큰 것으로 알려졌다.
또한 FDA로부터 받은 경고장은 공지되기 때문에 경쟁사 홍보, 미디어 보도 등으로 인해 마케팅에 악영향을 받을 가능성도 존재하고 있다. 미국 시장에서 소비자가 제품 사용을 통해 부상 등 손해를 입을 경우 형사처벌까지 가능하고, 소비자의 소송 등으로 많은 금전적 피해가 발생할 우려도 역시 존재한다. 향후 화장품 규제는 의약외품 수준으로 확대될 것이라는 전망까지 나오고 있는 실정이다.
임소현 무역관은 “미국에 화장품 수출을 준비하는 기업의 경우 미국 식약청의 규제를 파악하고 전 생산 공정이 미국 식약청 규제에 맞게 진행될 수 있도록 충분한 시간을 두고 준비해야 한다”고 지적했다.
미국 식약청의 화장품 생산 공정 규제와 레이블링에 대해 업체 스스로 파악하는 것이 어려울 가능성이 높아 FDA 규제 컨설팅 기관과의 상담도 고려해야 한다는 것. 또 모든 생산 공정과 규제 준수에 대한 기록을 보관해 미국 식약청이 현장 검증을 나왔을 때 제시할 수 있어야 피해를 예방 할 수 있다고 강조했다.
제품 레이블링에도 각별한 주의가 요구된다. 검증을 통한 미국 식약청 인정 없이 치료 효과를 주장하는 경우 잘못 표기된 것으로 간주되기 때문이다. 미국 식약청은 웹사이트, 포장, 브로셔 등 폭 넓은 심사를 실시하므로 제품 포장의 패키징 뿐 아니라 모든 부분에서 검증되지 않은 효과를 주장하지 않도록 주의해야 한다.
FDA의 규정을 준수하거나 성분 등록을 했더라도 FDA 마크 사용은 전면 금지돼 있음도 유념해야 한다. 이와 더불어 선크림, 기능성 제품의 경우 FDA의 의약외품(OTC) 규정을 충족해야 하는데, 이는 화장품 제조 규정보다 훨씬 강도 높은 수준의 규제로 더 많은 시간과 비용이 소요되므로 미국 시장 진출에 대해 더욱 철저한 대비가 필요하다.
임 무역관은 이 외에도 “마케팅 효과, 통관상의 용이함을 고려해 자발적화장품등록(VCRP, Voluntary Cosmetic Registration Program)을 할 경우 제품 성분에 대한 정확한 검토와 필요 시 즉각적으로 수정을 해야 한다”고 덧붙였다. VCRP에 제출한 화장품 성분과 미국 식약청의 검증에서 나타난 성분이 불일치할 경우 제품이 오염(adulterated)된 것으로 간주돼 불이익을 당할 수 있기 때문이다.
김혜란 기자의 전체기사 보기
Copyright @보건신문 All rights reserved.