지난해는 미 FDA로부터 새로운 신약들이 승인을 가장 많이 받은 해였고 이들 중 다수가 심각하고 생명을 위협하는 질환에 대한 신약으로 나타났다.
생명공학정책연구센터가 최근 소개한 자료에 따르면, 미 식품의약품안전청의 약물평가 및 연구(CDER)의 Johon Jenkins 박사는 블로그를 통해 “지난해 1년 동안 다수의 골수종을 치료하기 위한 4가지와 폐, 피부, 유방, 뇌, 결장직장 및 다른 암들을 치료하기 위한 것들을 포함, 다양한 종류의 암을 치료하기 위한 신약들이 대거 승인됐다”고 밝혔다.
또한 심장 쇠약(부전), 높은 콜레스테롤, 낭포성 섬유증 및 과민성 장 증후군 등을 치료하기 위한 신약들도 승인했을 뿐만 아니라 흔히 사용되는 혈액희석제에 대한 반전제도 최초로 승인됐다.
특히 2년 연속으로 희귀질환 치료제들이 승인되면서 미 FDA 사상 가장 많은 신약들이 승인된 것으로 나타났다.
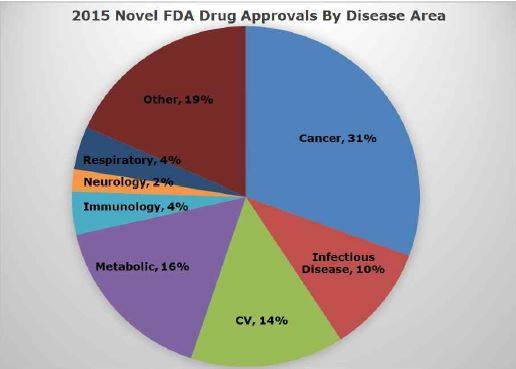
미국 바이오협회 산업분석팀에서는 2015년 식품의약품안전청의 약물평가 및 연구센터(CDER)와 생물학제제 평가 및 연구센터(CBER)에서 승인한 신약의 숫자를 누적해 기록해왔다.
이 둘을 합쳤을 때 무려 48건이 새롭게 승인된 것으로 나타났다. 이 수치는 대부분의 매체가 CDER의 45건 신약만을 보고한 것처럼 알려졌지만, 3건의 새로운 생물학제제가 2015년에 CBER에 의해 승인되면서 총 숫자는 48건으로 집계된 것이다.
CBER에 의해 승인된 3건의 생물학적 제제 치료제를 보면 △Amgen사의 Imlygic(암세포에서만 선택적으로 복제돼 암을 죽이는 종양세포 붕괴성 바이러스 암 치료제) △Novartis사의 Bexsero(수막구균성 질환 백신) △Baxalta사의 Adynovate(혈우병 A 치료를 위한 PEG화 FVIII 단백질)로 나타났다.
지난해 승인과 관련한 특징은, 신약 중 25%에 해당되는 12건은 획기적 치료제 지정(Breakthrough Therapy Designation)을 받았다는 점이다.
또한 16%에 해당되는 8건은 신속승인이었고, 2015년 승인된 신약 48건 중 90%에 해당되는 43건은 첫 번째 평가에서 승인을 받은 것으로 나타났다.
한편 69%에 해당되는 33건은 화합물 신약이었고 31%인 15건은 생물학적 제제로 나타났다. 이중에서 23%에 해당되는 11건은 새로운 작용 기전에 따른 First-in-Class에 속한 것으로 분석됐다.
이원식 기자의 전체기사 보기
Copyright @보건신문 All rights reserved.